Biologie
- Consommation
- Juridique
- Entreprises & marchés
- La page militante
- Sciences et société
- Santé publique
- Industrie agroalimentaire
- Inhibiteurs rénine-angiotensine-aldostérone
- Osmose
- Vasodilatateurs
- Science
- En bref...
- Technologie alimentaire et nutrition
- Nutrition
- Muscles lisses
- Aminés biogènes
- Obésité
- Biotechnologie
- Biologie
Tags : Biologie |
Échographie, radiologie, IRM... les méthodes d’imagerie les plus utilisées sont fondées sur un contraste spontané : les images naissent de l’interaction d’une onde et des constituants de l’organisme sans qu’aucune injection d’un quelconque élément ne soit requise. Ces méthodes fournissent le plus souvent une information anatomique, tandis que les méthodes d’imagerie fonctionnelle et moléculaire mettent en évidence les flux et les échanges de molécules. Pour ce faire, elles nécessitent l’introduction dans l’organisme d’un témoin du processus étudié, un traceur. Ce traceur, ou « mouchard », produit un signal que l’on détecte et qui le localise : on a ainsi accès à la répartition du traceur dans l’organisme, reflet des flux et des échanges étudiés. Aujourd’hui, la chimie offre des traceurs de plus en plus spécifiques d’un processus et nous verrons qu’ils révèlent les détails du fonctionnement des organismes vivants. Nous en décrirons quelques-uns à mesure que nous progresserons dans le corps en franchissant une à une les barrières rencontrées par ces traceurs (la paroi des vaisseaux sanguins, la membrane des cellules). Nous examinerons ensuite les traceurs, en cours de développement, dont la cible est l’information génétique des cellules. Enfin, nous verrons que l’on dispose aussi de traceurs intelligents qui, par exemple, guident l’action d’une substance thérapeutique.
Un traceur est une substance aisément décelable, naturelle ou artificielle qui, introduite dans un milieu, permet de suivre des processus physiques, chimiques ou biologiques qui s’y déroulent. Par exemple, des traceurs chimiques ou radioactifs sont utilisés en hydrologie pour étudier la dynamique des masses d’eau superficielles ou souterraines. La quantité de traceur doit être faible afin de ne pas perturber le processus.
En médecine, un traceur est le plus souvent constitué d’un vecteur, une structure qui reconnaît la cible, tel ou tel type de cellules, et d’une « balise », qui émet le signal (le plus souvent un rayonnement d’un élément radioactif), grâce auquel on repère la cible. De même, lors d’une course en mer, chaque bateau porte à son bord une balise émettrice, de type Argos. Ainsi, les organisateurs connaissent en continu la position des navires en recueillant le signal émis par les balises et relayé par les satellites.
Par ailleurs, les radiologues ont souvent recours à des agents pour modifier localement le contraste d’une structure, tels les vaisseaux sanguins et les voies digestives. Cet agent n’interagit pas avec des molécules spécifiques et la quantité utilisée est notablement supérieure à celle des traceurs, ce qui interdit toute évaluation des flux et échanges. On Obtient une sorte de « moulage » de la structure étudiée où l’on peut détecter, par exemple, un rétrécissement d’une artère.
De l’importance des capillaires
Les tissus d’un organisme sont constitués de divers types de cellules (on en compte plus de 200 chez l’être humain), chacun ayant un rôle défini. Pour ces cellules, l’apport en nutriments et en oxygène ainsi que l’élimination des déchets sont assurés par les échanges avec le sang au niveau des capillaires sanguins, l’ultime division des artères, dont la paroi est percée de « pores ». Ces derniers laissent passer le plasma des capillaires vers le milieu interstitiel où baignent les cellules, mais retiennent les grosses molécules et les globules rouges. Le système est en équilibre et l’eau du plasma ne s’accumule pas (sauf dans le cas d’œdèmes) : elle est réabsorbée dans les capillaires et rejoint la circulation sanguine en même temps que les déchets cellulaires. Certains métabolites, des hormones ou des médicaments, interagissent avec les cellules selon différents modes : ils sont reconnus par un récepteur ou un antigène exposé à la surface de la cellule, ou bien ils traversent la membrane cellulaire et rejoignent les voies métaboliques.
Le bon fonctionnement cellulaire est tributaire de l’intégrité de la filtration et du débit des capillaires. De l’efficacité de ces phénomènes dépend celle de la perfusion d’un tissu, c’est-à-dire du débit d’eau traversant une région tissulaire par unité de temps. Ces mouvements de plasma constituent la première étape dans l’ensemble des mécanismes d’échanges cellulaires. Voyons comment des traceurs révèlent la qualité de ces mouvements.
Deux types de traceurs intravasculaires sont utilisés pour l’étude du débit capillaire. Des molécules ou des éléments dont la taille est supérieure au diamètre des capillaires sanguins (de l’ordre de quelques micromètres) restent bloqués au niveau des capillaires. S’il existe une sténose (un rétrécissement artériel) en amont du réseau capillaire, les molécules traceuses sont moins nombreuses à y parvenir et l’on détecte l’anomalie, par exemple grâce à la radioactivité des traceurs (la radioactivité est trop faible). Ces traceurs restant « piégés » de façon stable, l’image peut être acquise à n’importe quel moment et fournit une carte des zones bien vascularisées et de celles qui le sont moins. De plus, avec un système d’imagerie adapté (qui mesure la radioactivité de façon périodique), on peut quantifier ces débits, la quantité de traceur étant proportionnelle au débit. Les molécules sont injectées à faible dose et très peu de capillaires sont obstrués (environ un sur 100 000) et ce, de façon transitoire, car les molécules sont« biodégradables ». Toutefois, ces traceurs ont un inconvénient majeur : après une injection intraveineuse périphérique, les molécules restent bloquées dans les capillaires pulmonaires, les premiers sur leur trajet. On peut détecter une thrombose artérielle pulmonaire en injectant des microbilles d’albumine, de dix micromètres de diamètre, marquées avec du technétium 99, un élément radioactif. Pour étudier d’autres organes, ces traceurs doivent être injectés par voie artérielle, ce qui limite leur utilisation chez l’être humain. Pour pallier l’inconvénient des traceurs intravasculaires et étudier de façon non invasive le débit capillaire de n’importe quel organe, on utilise un deuxième type de traceurs : des macromolécules plus petites qui passent dans les capillaires, mais ne traversent pas leur paroi. Les images doivent alors être acquises rapidement après l’injection du traceur, ce qui n’est possible que depuis peu. De cette façon, on étudie qualitativement les débits artériels par exemple avec des microbulles d’air en échographie et du gadolinium couplé à des macromolécules en IRM. Ces deux types de traceurs restent dans le sang.
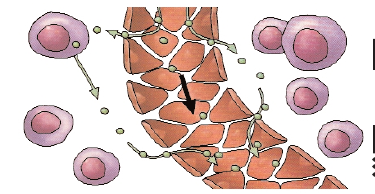 En revanche, pour étudier la perfusion tissulaire, on utilise
des traceurs qui traversent la barrière capillaire et diffusent
dans le milieu interstitiel, sans être dégradés ni s’accumuler dans les cellules. Ces traceurs sont
d’autant plus performants qu’ils ont un coefficient d’extraction élevé au premier passage, c’est-à-dire qu’une
proportion importante traverse la paroi des capillaires.
Une série de clichés est acquise dès l’injection du traceur,
durant la première minute, la variation locale du signal et
sa dynamique caractérisant la perfusion tissulaire. Le
traceur de référence est l’eau marquée à l’oxygène 15,
dont la présence, détectée par TEP chez l’homme ou
l’animal, révèle par exemple la perfusion myocardique.
En revanche, pour étudier la perfusion tissulaire, on utilise
des traceurs qui traversent la barrière capillaire et diffusent
dans le milieu interstitiel, sans être dégradés ni s’accumuler dans les cellules. Ces traceurs sont
d’autant plus performants qu’ils ont un coefficient d’extraction élevé au premier passage, c’est-à-dire qu’une
proportion importante traverse la paroi des capillaires.
Une série de clichés est acquise dès l’injection du traceur,
durant la première minute, la variation locale du signal et
sa dynamique caractérisant la perfusion tissulaire. Le
traceur de référence est l’eau marquée à l’oxygène 15,
dont la présence, détectée par TEP chez l’homme ou
l’animal, révèle par exemple la perfusion myocardique.
Au cœur de la cellule
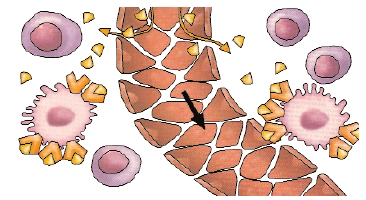
Arrivés à la porte des cellules, franchissons la dernière barrière. Des molécules qui passent la barrière capillaire, diffusent dans le milieu interstitiel et traversent la membrane cellulaire constituent des traceurs du métabolisme cellulaire. Selon la molécule choisie, différentes voies métaboliques pourront être étudiées. Ainsi, un analogue de la benzylguanidine marquée à l’iode suit les mêmes voies de captation et de stockage que la noradrénaline : il révèle par scintigraphie les cellules, notamment tumorales, qui captent et stockent cette molécule.
Une cellule devient à son tour un traceur quand on l’a rendue « remarquable », par exemple avec une molécule radioactive qui reste prisonnière dans le cytoplasme. Introduites dans la circulation, ces cellules, dont le processus de marquage ne doit pas modifier la fonction, constituent les marqueurs d’une population cellulaire spécifique. On peut ainsi détecter une accumulation anormale de globules blancs ou une fuite extravasculaire de globules rouges.
En imagerie in vivo, on ne met pas en évidence un gène, mais plutôt son expression, c’est-à-dire la production de la protéine qu’il code. Ainsi, la transformation tumorale d’une cellule, qui résulte d’une anomalie du génome, se traduit par exemple par une activité enzymatique anormale, par une quantité accrue de transporteurs membranaires exposés à la surface, par la fabrication d’antigènes ou de récepteurs normalement absents... Ces événements sont autant d’anomalies que les traceurs décrits précédemment peuvent révéler. Toutefois, l’association de ces sondes aux cellules tumorales est souvent peu spécifique et peu intense. Autre inconvénient, ces sondes sont souvent dégradées par le foie. Aussi, les travaux actuels portent sur le développement de sondes plus performantes pour étudier l’expression des gènes.
Certaines des sondes étudiées sont des antisens, c’est-àdire des fragments d’acides nucléiques complémentaires des séquences d’ADN (le gène) ou d’ARN, transcrit du gène, auxquelles ils s’associent par complémentarité : la protéine codée n’est plus fabriquée. Le passage du cytoplasme au noyau étant difficile, la cible la plus fréquente est l’ARN messager présent dans le cytoplasme. Quand la protéine codée a un effet délétère, la répression de sa synthèse par un antisens peut avoir un effet bénéfique. Enfin, l’utilisation d’un antisens marqué radioactivement révèle les cellules qui expriment le gène complémentaire. Ainsi, des biologistes ont élaboré un antisens radioactif spécifique de l’ARN messager de l’antigène nucléaire, une molécule abondante dans les cellules tumorales et dans les cellules musculaires lisses des parois vasculaires quand une lésion d’athérosclérose se développe. Cet antisens, en empêchant la fabrication de l’antigène nucléaire, ralentirait le développement de l’artériopathie mise en évidence par scintigraphie.
Des agents intelligents
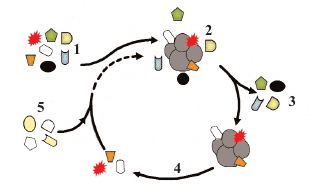 Cependant, les antisens sont volumineux et traversent
difficilement la membrane cellulaire, limitant le nombre
de cibles atteintes. Les aptamères n’auraient pas cet
inconvénient : il s’agit de petites molécules, constituées de
quelques nucléotides, sélectionnées par un processus
itératif et adaptatif, pour leur affinité envers une cible
donnée.
Cependant, les antisens sont volumineux et traversent
difficilement la membrane cellulaire, limitant le nombre
de cibles atteintes. Les aptamères n’auraient pas cet
inconvénient : il s’agit de petites molécules, constituées de
quelques nucléotides, sélectionnées par un processus
itératif et adaptatif, pour leur affinité envers une cible
donnée.
L’association d’un aptamère à sa cible est stable et spécifique (l’aptamère a été conçu à cette fin). Elle modifie parfois le phénotype tissulaire, c’est-à-dire ses caractéristiques. Aussi, rendus détectables par un traceur radioactif, les aptamères deviennent un outil d’imagerie et thérapeutique. Le récepteur HER3 (reconnu par un facteur de croissance épithélial) est souvent plus abondant à la surface des cellules tumorales qu’à celle des cellules saines. Des aptamères spécifiques de ce récepteur, marqués par un émetteur de positons (le fluor 18 par exemple), en cours d’élaboration, détecteraient les cellules malignes, mais aussi, en bloquant le récepteur, ralentiraient le développement de la tumeur.
Une des voies thérapeutiques prometteuses est la thérapie génique, qui consiste à introduire dans l’organisme un gène normal de façon à pallier la déficience de celui qui est muté. Afin d’évaluer in vivo le bon fonctionnement de ces gènes insérés, on a recours à un autre type de traceurs, les gènes rapporteurs. On associe au gène thérapeutique un autre gène dont l’expression est identique ; les deux protéines codées sont en quantités équivalentes. Ainsi, une sonde spécifique de la protéine rapporteuse confirme, ou non, l’efficacité de la thérapie génique.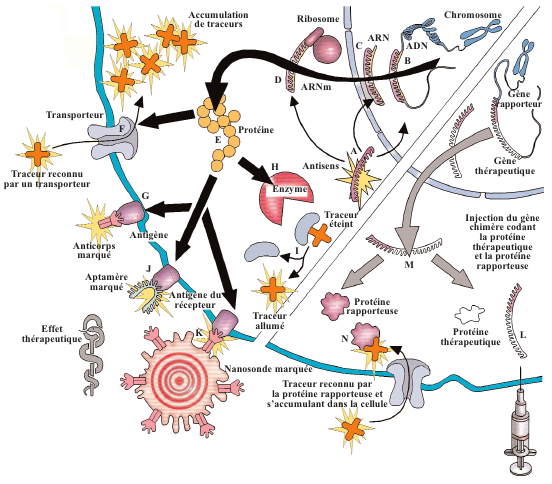
Aujourd’hui, les biologistes s’intéressent de près aux agents de contraste qui n’émettent un signal qu’après l’action d’une enzyme. En révélant cette dernière, ces agents jouent le rôle de traceurs. Par exemple, on a mis au point des complexes de gadolinium qui, en l’absence d’une enzyme spécifique, ne créent aucun contraste. En revanche, quand l’enzyme est présente, elle dégrade ce complexe et un signal apparaît. Toutefois, ces complexes doivent être associés à des « navettes » qui traversent les membranes pour rejoindre le milieu intracellulaire. Des marqueurs pour l’imagerie optique sont élaborés selon le même principe : aucune fluorescence n’est émise tant que le fluorochrome n’est pas séparé par une enzyme du reste du complexe, dont une région « éteint » la fluorescence.
Autre dispositif, les nanosondes hybrides associent des composants qui émettent un signal détectable et d’autres dotés de vertus thérapeutiques. L’épithète « hybride » se réfère à ce double avantage, mais aussi au fait que les signaux peuvent être reconnus par plusieurs méthodes d’imagerie complémentaires, par exemple anatomique et fonctionnelle. La spécificité du complexe résulte de la greffe d’une molécule (le ligand d’un récepteur ou un anticorps) qui ne reconnaît qu’un type de cellules. Par exemple, des sondes polyfonctionnelles et neutrophages (elles capturent des neutrons thermiques) sont constituées d’un cœur en oxyde de gadolinium, source d’un signal IRM et optique, qui a un effet délétère sur les cellules les ayant incorporées, car il concentre les neutrons émis par un faisceau extérieur. Associées à des anticorps spécifiques des cellules tumorales, celles-ci seraient repérées et détruites en un seul examen. Ici, le champ d’irradiation n’est pas restreint et les doses délivrées peuvent être plus élevées, car il n’y a pas d’effet nocif sur les cellules normales.
L’imagerie médicale fonctionnelle repose sur l’utilisation de traceurs, qui autorisent d’ores et déjà l’exploration de nombreux mécanismes à l’échelle tissulaire ou cellulaire. Cependant, l’évolution de nouvelles thérapies requiert de nouvelles sondes pour mieux cibler la cellule, et notamment son génome. L’accent est mis sur le marquage de ces sondes, mis au point avec des biologistes moléculaires, pour rendre le ciblage des sites spécifiques, détectables in vivo et de façon non invasive. Si des cibles strictement intranucléaires, tel l’ADN, sont impossibles à atteindre, il n’en demeure pas moins que l’association marqueurs et médicaments a de beaux jours devant elle.
